撰稿人:秦奕菲 沙琳琳
审阅人:袁鹰 葛妙妙 郭文天
摘要
2022年2月25日,DIA中国统计论坛第十期——FDA对BOIN方法的审核及修改意见解析——顺利召开。本次讲座特邀中国医学科学院肿瘤医院肝胆外科副主任赵宏教授担任主持,由思特尔(Cytel)中国公司高级咨询师秦奕菲博士主讲,特邀美国MD Anderson 癌症中心教授、BOIN设计原创发明人袁鹰教授,勃林格殷格翰制药公司(BI, US)肿瘤领域专家统计师葛妙妙博士,恒瑞医药临床研发部统计助理总监郭文天博士作为讨论嘉宾,详细介绍了FDA对BOIN方法的审核及修改意见,并针对大家关注的BOIN方法的焦点问题展开讨论。
背景
BOIN设计,全称是贝叶斯最优区间设计(Bayesian Optimal Interval design),是由美国德克萨斯大学MD Anderson癌症中心的袁鹰教授团队在2015年提出的一种I期临床试验剂量探索设计方法,具有操作简便,性能优良的特点。2021年12月10日,BOIN设计获得美国FDA Fit-for-Purpose官宣认证,肯定了BOIN设计的优越性能,并认证其适用于研究目的是确定最大耐受剂量(MTD)的I期临床试验,也是继获得中国CDE认可后(详见《抗肿瘤药物临床试验统计学设计指导原则(试行)》),BOIN设计在全球重要药品监管机构取得的又一重要认证。本期论坛重磅邀请BOIN设计方法学创始团队、国内外企业统计师代表及资深临床研究者,共同分享BOIN设计的理念与方法、探讨和解析FDA对BOIN方法的审核及意见,为I期剂量递增适宜方法选择提供参考。
关于Fit-for-Purpose (FFP) 认证
FFP认证是FDA针对药物开发工具(DDT)的一项认证。获得FFP认证意味着该DDT已预先通过FDA的审核。采用FFP认证的DDT进行药物开发活动,可以节省与FDA沟通的时间。此次BOIN设计是作为I期剂量探索的统计学方法获得FFP认证。
关于BOIN设计
BOIN设计是由Liu&Yuan(2015)提出的I期剂量探索方法。其基本原理和实现过程如下:
1. 设定一个目标毒性概率φ,一个较低毒性概率φ1和一个较高毒性概率φ2,适用于所有剂量。这三个参数要结合研究药物情况与临床研究者共同讨论确定。本文假设φ=0.25,φ1=0.15,φ2=0.35。
2. 在贝叶斯框架下,为φ,φ1,φ2各分配一个先验概率,即预先估计φ,φ1,φ2发生的可能性大小。此次FFP认证的是无信息先验下的BOIN方法,即φ,φ1,φ2发生的可能性相等,各为1/3。
3. 为了使决策错误最小化,先定义正确的决策和错误的决策,p_j在剂量j的条件下正确的毒性概率.H_0j是现在的剂量d_j就是MTD,决策应为维持。H_1j是现在的剂量d_j低于MTD,决策应为上升。H_2j是现在的剂量d_j高于MTD,决策应为下降。若做出正确的决策为R,ℇ,D,对应错误的决策为R ̅,ℇ ̅,D ̅。利用φ,φ1,φ2的先验概率,建立决策错误率(Decision error)函数。

求解极小值,在无信息先验下可以获得一个特例解λ1*和λ2*:

当观测值(p_j ) ̂≤ λ_1^*时,可以上升一个剂量,因为在这个条件下,当前剂量还未达到MTD。观测值(p_j ) ̂> λ_2^*时,可以下降一个剂量,因为在这个条件下,当前剂量已经超过MTD。这个解适用于所有剂量水平并且不受组样本量(cohort size)的影响。
具体的寻找合适剂量流程图图下图所示。

4. 根据修改后的定理1,λ1*和λ2*可以作为判断剂量上升/下降/保持的两个界值点。

通过比较DLT发生率与 λ1*和λ2*的大小,判断剂量上升/下降/保持,可以使决策错误率最小。

5. 在所有剂量上重复上述过程,直至达到试验终止条件。
FDA的审核意见
-
FDA在审核Liu and Yuan (2015) 时,发现了一些technical issues。申请人根据FDA的意见对相关问题做了改进。Fit-for-Purpose认证是针对改进后的BOIN设计。
-
申请人提交的材料,包括模拟研究,都是针对无信息先验下的local BOIN设计,因此Fit-for-Purpose认证也是仅针对无信息先验下的local BOIN设计。
-
申请人针对若干种I期剂量探索方法进行了模拟研究和对比。BOIN generally performed well in the simulation scenarios considered(但也不是说其他方法的表现不好)。在某些情况下,例如:剂量毒性关系非单调递增,或者存在毒性延迟,BOIN方法可能不适用。
-
结论:A multidisciplinary team … has reviewed all aspects of the submission. The review team finds that under the non-informative prior, the local BOIN design, in its revised form, can be designated fit-for-purpose.
-
授予BOIN方法FFP认证,并不排除其他I期剂量探索方法的使用。也不排除BOIN方法本身在非local的情况和有信息先验情况下的使用。
-
建议申请人的相关软件与BOIN方法的改进保持一致。
BOIN方法的修改及影响
1. 调整剂量上升/下降规则
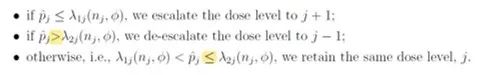
原规则为DLT发生率大于等于λ2j时,降低剂量。现修改为DLT发生率大于λ2j时,降低剂量。原规则为DLT发生率大于λ1j,小于λ2j时,保持剂量。现修改为DLT发生率大于λ1j,小于等于λ2j时,保持剂量。
由于现实中DLT发生率几乎不可能等于λ2j,此修改对于BOIN方法的使用没有影响。
2. 将界值点扩展为界值区间
假设cohort size=3,则DLT发生率为0/3,1/3,2/3,3/3。FDA认为介于0和1/3之间的任何值均可以作为界值,而不仅限于λ1*=0.197和λ2*=0.298。

作者根据FDA的意见,将原文中的界值点(point solutions)扩展为界值区间(interval solutions)。修改后的解为区间形式。
由于原方法中的界值点λ1*和λ2*已包含在界值区间λ1j和λ2j中,是修改后的解的一个特例,所以此修改对于BOIN方法的使用没有影响。
3. FFP认证的是无信息先验下的BOIN方法
由于在某些极端情况下,有信息先验的BOIN方法可能无法给出合理的λ1j和λ2j,例如:λ1j > λ2j,因此FDA只认证了无信息先验下的BOIN方法。作者相应修改了定理1,增加了无信息先验的限制条件。

如果是在无信息先验下使用BOIN方法,则不受此修改的影响。
总结
-
FFP认证是针对无信息先验下的、改进后的Local BOIN方法(本文中介绍的方法即为Local BOIN方法)。
-
除了采用有信息先验的情况外,FDA对于BOIN方法的修改意见对于已采用BOIN方法的试验设计没有影响。如果采用有信息先验的BOIN设计,建议重新评估。
-
FDA并未排除有信息先验下BOIN方法的使用,只是需要注意避免可能存在的问题。同时,FDA也未排除其他非FFP认证的I期剂量探索方法。
-
现有软件(如Trialdesign, EastBayes等)均采用无信息先验下的BOIN方法。如果是采用这些软件进行BOIN设计,不受此次修改的影响。
嘉宾讨论
讨论1:目标毒性概率Φ、过低毒性概率Φ1和过高毒性概率Φ2的选择
BOIN方法本身并不限制Φ1和Φ2的取值(只要在0~1之间). Φ1 represents a significantly underdosing toxicity rate such that the dose escalation is necessary; and Φ2 represents a significantly overdosing toxicity rate such that the dose escalation is necessary. BOIN minimizes the decision rule over these three cases. 因此,如果Φ1与Φ之间或Φ与Φ2之间的差异过小,在小样本下无法有效分辨这种差异带来的影响,optimization is not practically relevant。根据实践经验,Φ1=0.6Φ,Φ2=1.4Φ时,所获得的剂量探索结果与临床医生的经验判断相吻合。通常对Φ1和Φ2不需要进行calibrate。如果希望更保守一些,可以降低Φ2。
在I期剂量探索过程中,对于毒性有客观评价标准,例如:肝功能等血液指标,代谢指标等。这些客观指标会体现在方案中,并根据这些指标评价用药后的毒性。Φ、Φ1、Φ2一般由临床医生结合研究药物的特性,以及临床实践经验等进行选择,再通过模拟进行校准。目前常用的目标毒性概率Φ是25~30%。
讨论2:有信息先验与无信息先验
The effect of using informative prior is to influence the escalation and de-escalation boundary λ1* and λ2*。例如:如果给与Φ1较大的先验概率 (i.e., the prior says that the dose is very safe),那么当DLT发生率较高时,例如2/3,模型的决策可能仍然是保持甚至上升,但这通常与伦理和临床实际操作不符。I期试验中安全性是最重要的。The most important feature of dose finding is that we assess the safety of the dose sequentially one level at a time from low to high. 这就像摸着石头过河,即使我们知道当前这一步是安全的,我们并不知道下一步是否依然安全。Each dose level has the chance to be safe, acceptable or toxic. Thus, the most natural approach is to set non-informative prior for each level. Letting the DLT rate dominate the decision is safe and can avoid the conflict that the data show the dose is toxic (e.g., 2/3), but we still stay or escalation the dose because the prior says that it is safe.
如果同一个研究药物已在一个地区或人群上获得数据,这个信息可以应用于该药物在另一地区或人群上的研究,此时可以考虑有信息先验,但在借用信息时要格外谨慎。The prior information should not dominate the trial data. The historical information can be down weighted (e.g. through mixture prior distribution with non-informative component to control the effective sample size) to make sure that reasonable escalation decisions will be made when only limited data is observed in the trial, and that the calibrated informative prior can still improve the design efficiency. 先验信息也可以源自已上市同类药物或临床前数据,但这种信息借鉴的可靠性较难把握。
考虑到先验信息的可靠性问题,建议将先验信息用于确定进入研究的各个剂量水平,而不一定要放在模型中参与剂量上升/下降决策。总之,先验信息可以辅助决策,但应避免dominating the decision。
讨论3:界值点(point solutions)与界值区间(interval solutions)
将界值点修改为界值区间对于BOIN方法的使用没有任何影响。因为原方法中的解(λ1*和λ2*)就是位于界值区间内的一个特殊的解。在无信息先验下,界值点和界值区间做出的决策结果完全一致。此时,λ1*和λ2*是简单的解析解,而且作为剂量上升/下降决策的标准,不论cohort size或dose level是多少,这个标准并不随之改变,非常便于实际应用。
讨论4:如何确定一次入组的受试者人数(cohort size)?
实践中cohort size=3是沿用了传统3+3的惯例。同时也有临床的考量。如果cohort size等于1或2,会导致试验周期过长。如果cohort size较大,可能使更多受试者暴露在无效或过毒的剂量上。所以cohort size=3是一个折衷的选择。
在剂量很低的水平上,也可以进行加速滴定。注意此时不宜使用DLT作为毒性标准,应采用更低的毒性标准。如果确认有毒性发生,则应继续在当前剂量入组病人,并使用cohort size=3(一般来说是这样)的设计进行余下的剂量爬坡试验。
讨论5:选择无信息先验的BOIN设计和选择多个先验skeleton的BMA-CRM设计相比,哪个更具合理性?
BMA-CRM采用dose-toxicity 模型进行毒性估计和决策。Although it adopts multiple model and thus more robust than the CRM, it is still influenced by the model misspecification. 如果模型与真实情况相近,则效果好于无信息先验的BOIN设计。反之,则效果不好。BOIN does not make any assumption on dose-toxicity curve, thus more robust. 并且,BOIN设计采用无信息先验对于结果的影响不论好坏都比较有限,起作用的主要是实际观察到的DLT发生率。
讨论6:可否同时开展dose N和dose N+1试验?
可以。但当决策结果出现冲突时,例如,剂量N的决策为上升,剂量N+1的决策为下降,则建议采用保守的策略,暂停N+1的入组,只开展剂量N的试验,直到可以上升了,再继续N+1的试验。

参考文献
-
Liu, S. & Yuan, Y. (2015) Bayesian optimal interval designs for phase I clinical trials. Applied Statistics, 64, 507–523.
-
Zhou, H., Yuan, Y., Nie, L. (2018). Accuracy, Safety, and Reliability of Novel Phase I Trial Designs. Clinical Cancer Research, 24, 18, 4357-4364.
-
FDA.Drug Development Tools: Fit-for-Purpose Initiative. December 10, 2021. https://www.fda.gov/drugs/development-approval-process-drugs/drug-development-tools-fit-purpose-initiative.
-
Liu,S. & Yuan, Y. (2022) Erratum: Bayesian optimal interval designs for phase I clinical trials. Applied Statistics, 00, 1-2.
